Virus
Contrôler en continu vos solutions de vecteurs viraux pour la thérapie génique et cellulaire. Lentivirus, adénovirus, baculovirus de 80 nm à 500 nm…

Vésicules extracellulaires
Distinguer les différents types d’EVS pour vectoriser, diagnostiquer ou soigner, sur une gamme de taille de 80 nm à 500nm.

Phages
Analyser les mélanges complexes de phages pour des applications en écologie et phagothérapie. T4, P1 dès 80 nm…

Nanoparticules
Mesurer en temps réel tous les objets nanométriques dans une goutte. mRNA-LNP, Nanoplastiques, or, argent, nano-billes fluorescentes ou luminescentes…
Démonstration
Mesurer dans une goutte la concentration et la taille de nanoparticules
en moins d’une minute ? C’est parti…
Une mesure ultra rapide
grâce à 4 avantages déterminants
Videodrop filme en temps réel dans une simple goutte les particules biologiques entre 80 nm & 500nm et fournit une image microscopique jusqu’à 10 µm. Le dispositif compact, assisté d’un logiciel dédié, rend la manipulation très facile à réaliser. Aucun marquage n’est nécessaire sur l’échantillon analysé. On peut travailler sur des solutions non purifiées et sur de petits volumes d’échantillon (5 µL) avec une gamme de concentration de 10^8 à 10^10 particules/ml.

Résultats en temps réel

Facile
à utiliser

Sans
marquage

Sans
purification
Applications
Une proposition de valeur basée sur de slides démonstrations .
Videodrop, Performance qualification of a system measuring size & concentration of plastic nanoparticles
Technologie
Fondée sur les principes de l’interférométrie, le Videodrop permet de « voir » des nanoparticules biologiques dans la gamme 80-500 nm.
L’observation se déroule en 3 étapes.
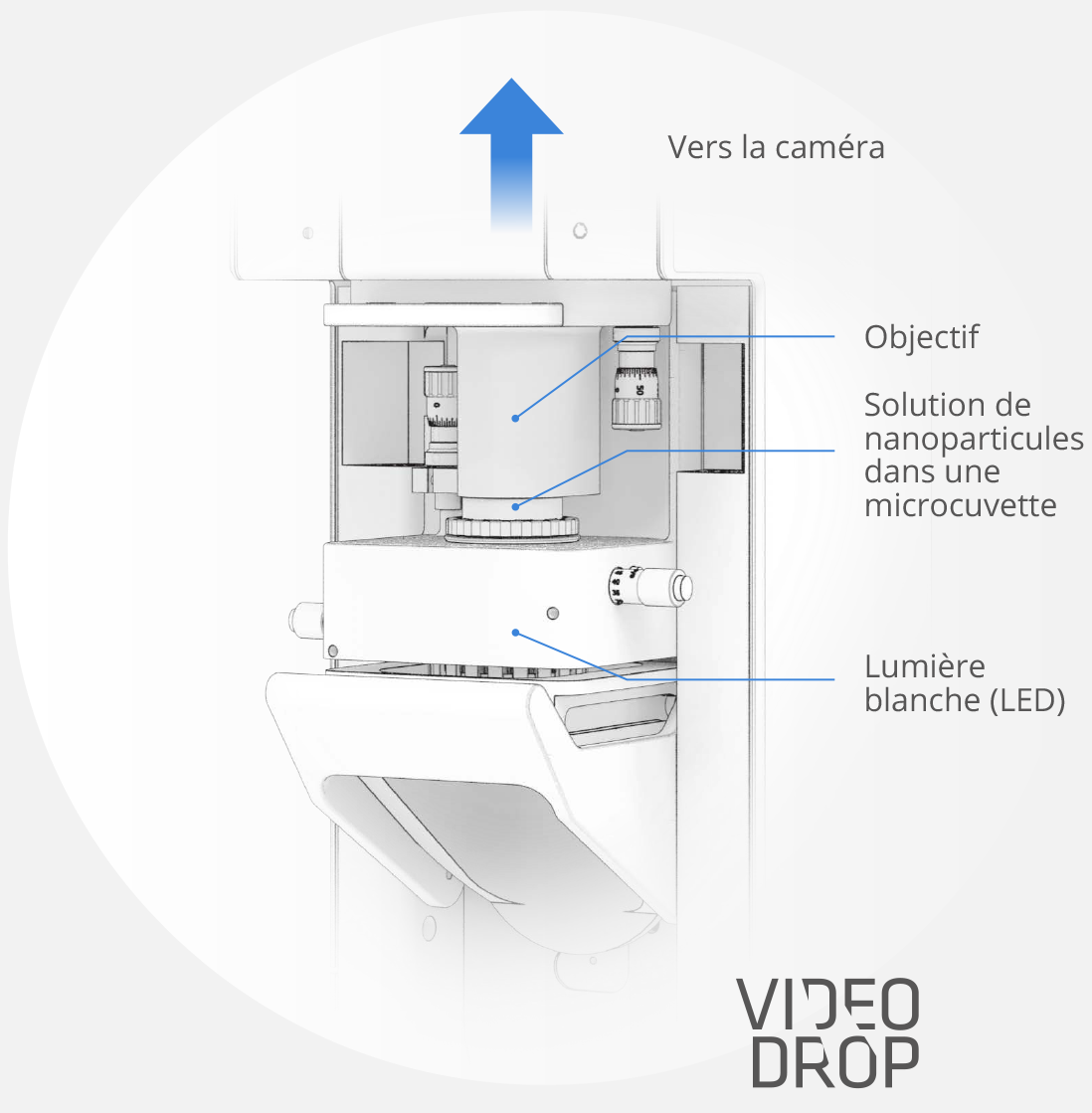
Le Dispositif
Une solution de 5 à 10 µL contenant les nanoparticules est placée dans une microcuvette éclairée par une simple LED, tandis qu’un système optique, couplé à une caméra, filme leurs mouvements.

La Vidéo
Le film obtenu montre en temps réel le déplacement des nanoparticules.
Un algorithme de tracking permet de suivre la trajectoire des éléments observés.

Observation d’une goutte au Videodrop : Chaque point noir/blanc correspond au signal interférométrique d’une nanoparticule.

L’Analyse
Grâce à son logiciel dédié, le calcul de la vitesse et des distances de ces trajectoires permet de définir le type, la taille et le nombre des éléments observés.
Le résultat s’affiche sur l’interface utilisateur de manière quasi instantanée.
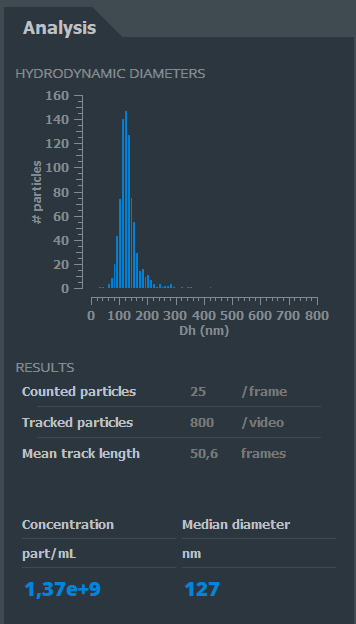
Interface utilisateur du Videodrop. Les résultats de l’analyse s’affichent en temps réél.
À PROPOS de Myriade
Myriade est une entreprise française créée en 2017 qui développe une technologie innovante d’imagerie de particules nanométriques.

Myriade est née du partenariat entre Quattrocento (Company Builder, spécialisé dans les équipements pour les sciences du vivants), Paris Sciences et Lettres, et l’équipe scientifique.
Issue des travaux de l’Institut Langevin, un laboratoire académique français spécialisé dans les technologies optiques et ultrasonores pour les sciences du vivant, la technologie du Videodrop repose sur une technique d’interférométrie mono-bras.
Elle permet de visualiser sans marquage des nanoparticules vivantes comme les virus, les phages, ou les vésicules extracellulaires.
Le procédé a été développé par le professeur Claude Boccara à la demande de la spécialiste en virologie, le professeur Martine Boccara, qui cherchait une méthode rapide pour répertorier des virus présents dans les échantillons d’eau de mer récoltée lors de l’expédition Tara Oceans en 2013.
*La technologie est protégée par une famille de brevet
TARA OCEANS
L’expédition Tara Oceans a eu pour objectif de faire l’inventaire des écosystèmes planctoniques marins (depuis les virus jusqu’aux larves de poissons) dans le but de comprendre leur fonctionnement, mais aussi d’anticiper leur relation aux changements climatiques.
Elle a navigué pendant 6 mois et parcouru 25 000 km pour mener à bien sa mission. Et le 22 mai 2015, la prestigieuse revue Science publiait les cinq premiers grands résultats scientifiques de l’expédition. Depuis, des centaines de chercheurs d’institutions prestigieuses analysent les échantillons recueillis et multiplient les découvertes.

Le bateau Tara a quitté Lorient le 19 mai 2013 pour revenir le 6 décembre de la même année après avoir parcouru 25 000 km.
L’ÉQUIPE OPÉRATIONNELLE

Philippe GARABEDIAN
Ventes, Marketing & Operations

François MAZUEL
R&D, Production & Support

Marie BERGER
Applications

Lucas IONESCO
Business Developement

Donatien RAMIANDRISOA
R&D

Kevin AFFANNOUKOUE
R&D

Nicolas Rose
Applications & Support
L’ÉQUIPE SCIENTIFIQUE

Pr Martine Boccara
Virologue, professeur à l’UPMC, ancien membre de l’IBENS, chercheur au Muséum d’Histoire Naturelle.

Pr Claude Boccara
Physicien français, spécialiste en optique. Il est directeur scientifique honoraire de ESPCI et membre du conseil scientifique de l’Institut Langevin.
LES PUBLICATIONS
| Reference | Title | Institution | Type | Link |
|---|---|---|---|---|
| Boccara M, et al. | Full-field interferometry for counting and differentiating aquatic biotic nanoparticles: from laboratory to Tara Oceans. | Institut Langevin, ESPCI ParisTech, PSL Research University, Paris, France | Virus | Link |
| Turkki V, et al. | Experimental Evaluation of an Interferometric Light Microscopy Particle Counter for Titering and Characterization of Virus Preparations. | KCT, Kuopio Center for Cell and Gene Therapy, Finland | Lentivirus | Link |
| Reference | Title | Institution | Type | Link |
|---|---|---|---|---|
| Sabbagh Q, et al. | The von Willebrand factor stamps plasmatic extracellular vesicles from glioblastoma patients. | SOAP, CRCINA, Université de Nantes, France | EVs | Link |
| André-Grégoire,G., et al | Inhibition of the pseudokinase MLKL alters extracellular vesicle release and reduces tumor growth in glioblastoma. | SOAP, CRCINA, Université de Nantes, France | EVs | Link |
| de Poret, A., et al. | Extracellular vesicles containing the I-BAR protein IRSp53 are released from the cell plasma membrane in an Arp2/3 dependent manner. | CEMIPAI, CNRS Montpellier, France | EVs | Link |
| Sausset, R., et al. | Comparison of interferometric light microscopy with nanoparticle tracking analysis for the study of extracellular vesicles and bacteriophages. | INRAe, Jouy en Josas, France | EVs | Link |
| Troha, K., et al. | Autologous Platelet and Extracellular Vesicle-Rich Plasma as Therapeutic Fluid: A Review. | Laboratory of Clinical Biophysics, University of Ljubjanja, Slovenia | EVs | Link |
| Takada, A., et al. | Exploration of microRNA Biomarkers in Blood Small Extracellular Vesicles for Enzootic Bovine Leukosis. | Faculty of Applied Biological Sciences, Gifu University, Japan | EVs | Link |
| André-Grégoire,G., et al | Isolating plasma extracellular vesicles from mouse blood using size-exclusion chromatography, density gradient, and ultracentrifugation. | SOAP, CRCINA, Université de Nantes, France | EVs | Link |
| Reference | Title | Institution | Type | Link |
|---|---|---|---|---|
| Roose-Amsaleg C, et al. | Utilization of interferometric light microscopy for the rapid analysis of virus abundance in a river. | Institut de Biologie de l’Ecole Normale Supérieure (IBENS), PSL Research University, Paris, France | Phages | Link |
| Dugat-Bony E, et al. | Viral metagenomic analysis of the cheese surface: A comparative study of rapid procedures for extracting viral particles. | INRA, AgroParisTech, Université Paris-Saclay, Jouy-en-Josas, France | Phages | Link |
| Reference | Title | Institution | Type | Link |
|---|---|---|---|---|
| Ryo Kato, et al. | Highly Stable Polymer Coating on Silver Nanoparticles for Efficient Plasmonic Enhancement of Fluorescence. | Institute of Post-LED Photonics, Tokushima University | Silver nanoparticles | Link |
| Romolo, A., et al. | Assessment of Small Cellular Particles from Four Different Natural Sources and Liposomes by Interferometric Light Microscopy. | Laboratory of Clinical Biophysics, University of Ljubjanja, Slovenia | Evs, liposomes, spruce vesicles | Link |
| Jeran, M., et al. | Small Cellular Particles from European Spruce Needle Homogenate. | Laboratory of Clinical Biophysics, University of Ljubjanja, Slovenia | Spruce vesicles | Link |